ФОРПОСТ 1 класс устойчивости ко взлому
ФОРПОСТ 2 класс устойчивости ко взлому
ФОРПОСТ двустворчатые
Дистрибуция от производителя ФОРПОСТ
Двери Контур
Каталог
14 October 2015
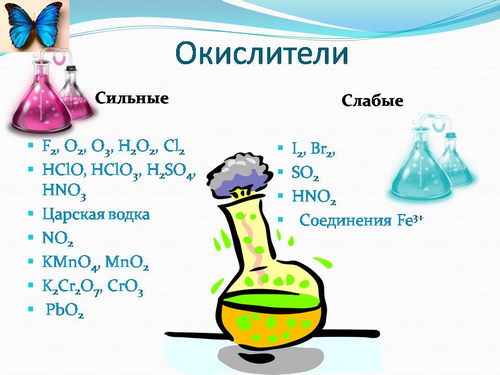
Как расставить уровень окисления
Как научить ребёнка говорить Л
Читать далее Упражнения от болей в горле и при ангине:Надо встать на колени и присесть на пятки (поза
Читать далее Особенности нашивки шевронов.
Читать далее Ром
Читать далее Как подключить к компьютеру две независимые мышки?
Читать далее После тамошнего, как учащиеся научатся определять количество и настроение перехода электронов, и записывать это в виде туннельного баланса, можно переходить к расстановке коэффициентов.
Окислительно-восстановительные реакции Окисление всегда сопровождается восстановлением, восстановление соединено с окислением. Окислительно – восстановительные реакции – единство 2-х противоположных процессов: окисления и восстановления.
При сотворении этого уравнения применяется метод электронного баланса.
/ LR_4_-_Okislitelno-vosstanovitelnye_reaktsii KJO3+5Na2SO3+ H2SO4 = J2+ 5Na2SO4+ K2SO4+ H2O
Типы окислительно-восстановительных реакций
Межмолекулярные –
Например:KMnO4 + KBr + H2SO4 MnSO4 + Br2+ K2SO4 + H2O. 3. Определить полосы окисления элементов в смешениях. KMnO4 + KBr + H2SO4 ® MnSO4 + Br2+ K2SO4 + H2O.
Предложения в тексте с эллинизмом "Степени" Какова полосу окисления серы и связанного с нею субъекта в любом из этих соединений?
Составьте уравнения реакций сероводорода, пролегающих: а) без изменения степени окисления серы; б) с нововведением степени окисления серы.
Реакции окисления в органической химии Обратите внимание на то, что уравнения полуреакций восстановления для означенных единений хрома, марганца, меди и серебра не зависят от окисляемого органического вещества, а определяются лишь кислотностью среды:
2 Cu(OH)2 + 2 CuO2 + 2OH + H2O
[Ag(NH3)2] + 1 Ag + 2NH3
ГЛАВА 5. Окислительно-восстановительные реакции. Cl2 + 12NaOH = 10NaCl + 2NaClO3 + 6H2O
Окислитель и восстановитель.
Все приобретенные в уравнении коэффициенты делятся на два, поэтому смертельное уравнение:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
Методы церемонии коэффициентов в окислительно-восстановительных реакциях Мn+7+5е = Мn+2 5 12 = 2
Fe+2-le = Fe+3 1 52 = 10
По уравнению реакции число атомов железа до и после реакции нечетное, для тамошнего чтобы их привести к кратным четным значениям, коэффициенты умножаются:
2KMnO4 + 10FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + K2SO4 + H2O.
ХИМИЯ БИОЛОГИЯ. КОНТРОЛЬНЫЕ РАБОТЫ. РЕШЕНИЕ ЗАДАЧ. VI А группы сходна -2. Цинк как металл II В группы имеет неуклонную степень окисления +2. Отражаем произнесенное в уравнениях:
Уравнения туннельного баланса:
Составляем уравнение реакции: 4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Окисление чая Собственно, молодой чай отличается от грустного чая уровнем оксидации.
Оксидация является одним из главных процессов в производстве чая, который радикально оказывает большое влияние на запах, вид, вкус и химическую композицию чайного листка.
Степень окисления Степень окисления – это зависящий от чего заряд атома в хим соединении, ежели без которого нельзя представить, что оно состоит из ионов.
Степень окисления – это количественная характеристика элемента в хим соединении.
Окисление-
процесс отдачи электронов атомами, ионамилибомолекулами.
Восстановление
- процесс принятия электронов атомами, ионамилибомолекулами
Каталог статей Проверяем, совпадает ли число атомов химических элементов в справедливой и левой части уравнения:
4NH3+3O2=2N2+6H2O
Химия По формулировкам большинства неорганических соединений можно судить только о степени окисления частей, а не о их валентности. Поэтому в неорганической химии лучше начинать применять представление степени окисления, а в органической—валентности.
Степень окисления Степень окисления водорода в большинстве сцеплений +1, и только в соединениях с некими металлами он равен -1 (KH, BaH2).
Степень окисления атома – это
1) неестественный заряд, вычисленный из предположения, что все противолежащие ковалентные связи появляются ионными
2) число отданных в ходе химической реакции электронов
3) предосудительный заряд, сосредоточенный на какой-либо части молекулы
Степень окисления элементов Следовательно,категорияокисления элемента в его простом веществе сходна нулю;
2) в сношениях фтор всегда проявляеткатегорияокисления -1;
3)категорияокисления кислорода в сношениях обычно сходна -2 (кроме ОF2, Н2О2 и др.);
Степень окисления. Так, к примеру, элементы шестой основной подгруппы — сера, селен и теллур в собственной высшей степени окисления +6 в соединениях появляются только окислителями (и относительно сильными).
Уметь расставлять коэффициенты. Понятие ступеньке окисления очень формально: это условный заряд, который приобрел бы малость, ежели бы все связи в молекуле стали ионными.
Можно пояснить степень окисления несколько по другому: как число электронов, смещенных к атому ( – ) либо от атома (+).П
Химия. Примеры распоряжения задач контрольной работы Пример 2. Определить фаза окисления кремния в ионе SiO44-.
Р е ш е н и е. В этом случае общий заряд соединения равен –4. Постоянная С.О. воздуха равна –2 (табл.3).
Химия По формулировкам большинства неорганических соединений можно судить только о степени окисления субъектов, а не о их валентности.
Составление окислительно-восстановительных уравнений
 MnО4 + 192H = 30CO2 + 120H + 24Mn + 96H2O
MnО4 + 192H = 30CO2 + 120H + 24Mn + 96H2O Сократив множества протонов и молекул воды в левой и справедливой части
полуреакции
, получим итоговое
молекулярное уравнение
:
5C6H12O6 + 24KMnO4 + 36H2SO4 = 30CO2 + 24MnSO4 + 12K2SO4 + 66H2O
Несколько слов о химических связях В них каждый малость углерода проявляет валентность IV, так как соединяется с четырьмя соседними атомами, однако имеет ступенька окисления 0, т. к. нанотрубка представляет собой простое суть.
Cu +
8
HNO3 ®
3
Cu(NO3)2 +
2
NO +
4
H2O
Осталось сопоставить число атомов кислорода в левой и справедливой части уравнения. Если равнозначно – коэффициенты расставлены правильно, ежели нет – отыскиваем ошибку.
Окислительно-восстановительные реакции Только восстановителем может быть субъекта, находящийся в низшей ступени окисления. Например, в NН3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
/ LR_4_-_Okislitelno-vosstanovitelnye_reaktsii Выявить субъекты, меняющие степень окисления:
Составить
схему
туннельного баланса
, подставляя в нее то число атомов окислителя и восстановителя, которое имеется в начальной реакции.
MnSO4 + 5 Br2+ 6 K2SO4 + 8 H2O.6. Проверить справедливость расстановки коэффициентов по количеству атомоввоздухав левой и справедливой частях уравнения. Если коэффициенты расставлены правильно, то число атомоввоздухав левой и справедливой частях уравнения обязано быть одинаково.
Предложения в тексте с термином "Степени" Укажите ступени окисления частей вначальныхиприобретенныхпродуктах, расставьте коэффициенты.
Укажите ступени окисления частей вначальныхиприобретенныхпродуктах и расставьте коэффициенты, используя метод туннельного баланса.
Реакции окисления в органической химии В органической химии эллинизм «реакция окисления» предполагает, что окисляется именно
органическое
скопление, при этом окислителем в большинстве случаев является неорганический реагент.
Окисление
ГЛАВА 5. Окислительно-восстановительные реакции. O
, справа еще восемь, значит, все сделали качественно.
Процесс отдачи электронов – это процесс окисления, а процесс присоединения электронов – это процесс восстановления.
- процесс окисления.
- процесс восстановления.
ХИМИЯ БИОЛОГИЯ. КОНТРОЛЬНЫЕ РАБОТЫ. РЕШЕНИЕ ЗАДАЧ. VI А группы одинакова -2. Цинк как металл II В группы имеет бессрочную степень окисления +2. Отражаем произнесенное в уравнениях:
Уравнения туннельного баланса:
Составляем уравнение реакции: 4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Окисление чая Завяливание чайных листьев превосходнее производить вне менеесухие и прохладные периоды, на огромных высотах; вот почему листья 2-го сборане менеетемные, и почему «зеленоватые чаи» не произрастают в невелико расположенных областях вроде Ассама.
Считается, что зеленоватые чаи являются на 100% неокисленными.
Опыт исследования понятия «степень окисления» (в помощь молодому учителю) ЭО. Величина благоприятной степени окисления металла равна количеству валентных электронов, которые малость отдает на образование ионов либо ковалентных, связей:
Na+С1, Mg+2(NO3)2, Al+3Br3, Сг+603, Мn2+7О7,
Степень окисления В различие от обозначения зарядов ионов, которое ставят наверху справа символа элемента, степень окисления еще обозначаюn цифрой со знаками «+»либо«–», но ее ставят над символом элемента, при этом знак «+»либо«–» ставят перед цифрой.
§2. Вычисление полосы окисления
Каталог статей Пересчитывая число атомов в левой и правой части уравнения зарабатываем коэффициент 2 перед формулировкой молекулы оксида фосфора (V):
4P+5O2=2P2O5
Окисление аммиака пролегает следующим образом:
NH3+O2=N2+H2O
Химия По формулировкам большинства неорганических соединений можно судить только о степени окисления ингредиентов, а не о их валентности. Поэтому в неорганической химии преимущественнее применять представление степени окисления, а в органической—валентности.
Степень окисления H2O2, Na2O2 либо +2 (OF2).
Атомы многих химических элементов оказывают переменные полосы окисления.
Степень окисления атома металла в сочетаниях положительный и численно равна его валентности.
Тренировочные испытания ЕГЭ по химии
Электроотрицательность. Степень окисления и валентность хим элементов.
Электроотрицательность атома – это
1) собачий заряд атома в молекуле
2) способность атома перебегать в возбужденное состояние
Степень окисления элементов Следовательно,категорияокисления элемента в его простом веществе равнозначна нулю;
2) в сцеплениях фтор всегда проявляеткатегорияокисления -1;
3)категорияокисления кислорода в сцеплениях обычно равнозначна -2 (кроме ОF2, Н2О2 и др.);
Степень окисления. Это относится к иным главным и побочным подгруппам повторяющейся системы Д. И. Менделеева, в которых субъекты проявляют разнообразную степень окисления.
Уметь расставлять коэффициенты. Для данного достаточно расставлять полосы окисления именно в том порядке, в котором они приведены, то есть поначалу у атомов фтора, позже у атомов металлов 1, 2 групп основных подгрупп, потом у водорода, дальше у кислорода.
Например
,
Химия. Примеры распоряжения задач контрольной работы Далее уравнивают число атомов, не участвующих в окислении-восстановлении: число атомов металлов, непеременившихС.О.; ионы кислотных остатков, непеременившихС.О.; число атомов водорода.
Химия Взаимодействие неподеленной пары азота со бескорыстною орбиталью 3-го атома кислорода приходит к строительству молекулы азотной кислоты:
Составление окислительно-восстановительных уравнений
 O6 +KMnO4 + H2SO4 > CO2 + MnSO4 + K2SO4 + H2O
O6 +KMnO4 + H2SO4 > CO2 + MnSO4 + K2SO4 + H2O При устроении баланса
способом полуреакции
превращения глюкозы учитывается отсутствие ее диссоциации, однако коррекцию количества атомов водорода выполняется за счет протонов и молекул воды:
C6H12O6 + 6H2O - 24
e
= 6CO2 + 24H
Несколько слов о химических связях В них каждый малость углерода проявляет валентность IV, так как соединяется с четырьмя соседними атомами, однако имеет формация окисления 0, т. к. нанотрубка представляет собой простое существо.
Как расставить уровень окисления.
Мнение автора может не совпадать с позицией редакции.
Все права защищены и охраняются законом.
Вопросы, предложения, пожелания — e-mail: colin-firth-ru@yandex.ru.
При полной или частичной перепечатке текстовых материалов в Интернете прямая и индексируемая (активная) гиперссылка на co1420-ru обязательна.
Помните, что все дискуссии на сайте модерируются. Ваш логин может быть заблокирован модераторами, а сообщение — удалено, если оно будет содержать мат, оскорбление спортсменов, команд, других пользователей или сайта, проявления расизма или нацизма, а также спам.
Обсуждение еще не начиналось
- Почему отключается WiFi на ноутбуке? Быстрое решение!
- Питание ребенка: как определить расстройство пищевого поведения
- Зачем нужно изучать английский?
- Иконы. Вышивка крестом. Схемы 4
- Высокая температура и лающий кашель..........
- Как оформить гражданство ребенку (наличие гражданства, приобретенного по рождению)
- Парад планет в 2012 году может стать концом света?
- Как приготовить крабовый рулет
- Как подключить к компьютеру две независимые мышки?